
ガイドライン、臨床で使われていますでしょうか?
脳卒中リハビリテーション領域では、日本脳卒中学会が出版している『脳卒中治療ガイドライン2021』や日本理学療法士協会が出版している『理学療法ガイドライン第2版』が主要なガイドラインです。
ガイドラインを臨床で使うメリットを一言で言えば、『患者さんがよくなる』です。
本記事では、なぜガイドラインを読むことで患者さんがよくなるのか解説します。
脳卒中リハビリにおいてガイドラインが患者さんに有益な理由
最初に本記事のまとめです。
- Evidence Based Practiceは患者さんによくなっていただくための取り組み
- “臨床研究” に基づくことで患者さんに有益なリハビリを提供することができる
- ただし臨床研究は1つ2つ読むだけでは間違ったリハビリを提供する可能性がある
- だから情報の全体を把握することが大事で、ガイドラインは情報の全体を教えてくれる
- ガイドラインに従うことで患者さんにとって有益なリハビリを提供することができる
ざっくりまとめると、『ガイドラインは世界中で有効と報告されている介入方法のまとめ情報』であり、ガイドラインに従うことで患者さんにとって有益なリハビリを提供することができるようになる、ということです。
なぜEvidence Based Practiceが大事なのか?
脳卒中リハビリには様々な方法があります。
例えば、トレッドミルトレーニング、課題指向型訓練、ミラーセラピー、電気刺激療法、体幹トレーニング、など数え出したらキリがありません。
これら複数のリハビリの選択肢の中から、セラピストは患者さんにとって最善のリハビリを選択します。
…このように言うのは簡単ですが、実際それを選ぶのが難しいんですよね。
でも、下図のようにリハビリの効果がわかっていたらどうでしょう?
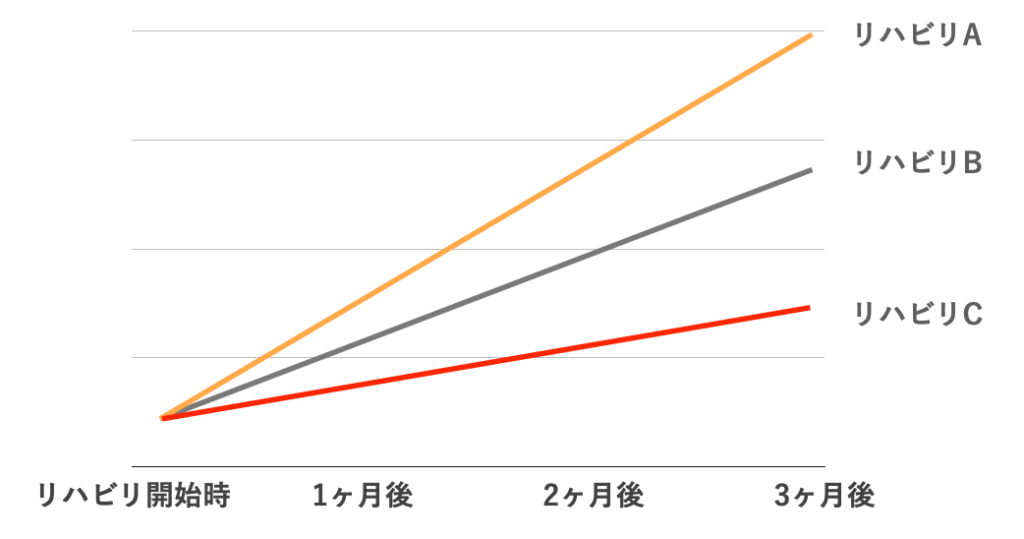
3ヶ月後に一番良い結果が得られるのがリハビリAだとわかってたら、多くの方がリハビリAを選ぶのではないでしょうか。
このように、”各リハビリを行ったときにどうなる可能性が高いか” を教えてくれるのがエビデンスです。
つまり、リハビリの効果を教えてくれるのがエビデンスであり、患者さんにとって最善の治療をしようという取り組みがEvidence Based Practiceである、ということです。
Evidence Based Practiceって何?
Evidence Based Practice(以下、EBP)は、”エビデンスに基づく実践” です。
似たような言葉にEvidence Based Medicine(以下、EBM)、Evidence Based Physical Therapy(EBPT)、などがありますが、これらはEBPに含まれる概念です。

近年では自費リハビリも増えてきています。
自費リハビリは医療保険や介護保険外のサービスであり、医療行為ではないことからEBMやEBPTという言葉を使用することが適切ではないと考え、私自身は “EBP” という言葉を使うことが多いです。
世界ではEBPが広がってきている

日本では、近年になってEBPやEBM、EBPTといった言葉をよく聞くようになりました。
しかし、世界では何年も前からその重要性が認識されています。
例えば、アメリカでは2003年の時点で90%、カナダでは2007年の時点で93.2%、フランスでは2009年の時点で80%のセラピストが『EBPが必要もしくは重要』と考えている、と報告されています。
また、アメリカでは2003年の時点で65%、カナダでは2009年の時点で62.3%のセラピストがEBPのために文献検索を毎月行う、と報告されています。
このように、世界中では20年近く前からEBPへの関心が高いことがわかります。
なぜEBPが世界で広まっているのか?
EBPが広まっているのには理由があります。
現在こそ、EBPの大事さが認識されていますが、30年ほど前は理論や経験に基づく医療が行われていました。
そのひとつに、『心筋梗塞後の患者さんに対して不整脈の薬を処方する』という医療がありました。
当時、心筋梗塞を発症した患者さんが不整脈を発症し、その後心停止に至る方が多かったためです。
理論的に考えれば、不整脈を薬で予防してしまえば心停止になる可能性を下げられますよね。
しかし、薬を処方してもやはり亡くなる方はいらっしゃいました。
そこで、本当に不整脈の薬が有効なのか検証されました(CAST STUDY)。
心筋梗塞患者さんおよそ1500人に協力いただき、患者さんを『不整脈の薬を処方するグループ』と『処方しないグループ』に分け、経過観察を行いました。
不整脈の薬が有効なのであれば、『不整脈の薬を処方するグループ』の方が死亡率が低いはずです。
しかし、結果としては『不整脈の薬を処方するグループ』の方が死亡率が高かったという結果になりました。
『心筋梗塞後に不整脈を起こし、心停止してしまうのだから、不整脈を抑えよう』という考えは理論的に正しいですよね。
理論的に正しいはずのことをやっていたにもかかわらず、実は患者さんに害を与えていた、という衝撃の結果になりました。
この時期、別の治療法でも同様な結果が報告されたこともあり、時代は “良くなるだろう、正しいだろうという理論・経験に基づく医療” から “良くなる・正しいという証拠(Evidence)に基づく医療” へと変わっていきます。
私たちセラピストも歴史から学ぶことは多いです。
EBPにおけるエビデンスとは?
さて、EBPにおいて、エビデンスとは何を指すのでしょうか。
エビデンスには2種類あるとされています。
ひとつはClinical Research Evidence、臨床研究です。
もうひとつはBasic Science Research Evidence、基礎研究です。
EBPでは “まずClinical Research Evidenceを参考にすべき” とされています。
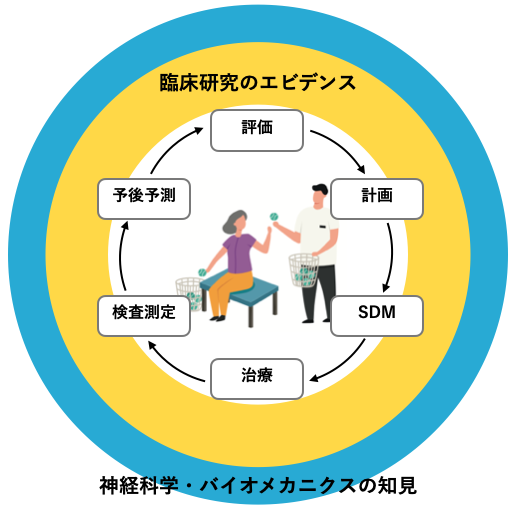
Clinical Research Evidence (臨床研究)とは?
人間を対象し、病気や怪我に関する診断、介入、予防、予後に関する疑問に答える研究です。
例えば、脳卒中患者さんに対する特定のリハビリの効果を検証したランダム化比較試験、コホート研究、ケースコントロール研究などが当てはまります。
本記事はガイドラインの記事になりますので、 “介入” に絞って話を進めます。
介入に関する臨床研究の代表格は “ランダム化比較試験” です。
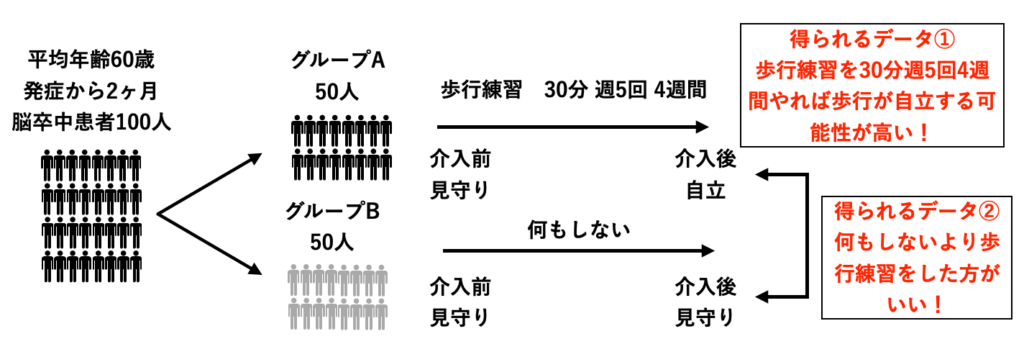
臨床研究に基づくEBPのイメージ①

平均年齢60歳の歩行見守りレベルの脳卒中患者に対し、トレッドミルトレーニングを30分、週5回、4週間行ったら4週後に屋内歩行自立レベルになった。

担当の脳卒中患者さん(60歳・歩行見守りレベル)に、トレッドミルトレーニングを30分、週5回、4週間行ったら4週後に屋内歩行が自立する可能性が高いぞ!
トレッドミルトレーニングの効果を報告したランダム化比較試験を参考にし、自分の担当患者さんへのリハビリプログラムを立案します。
臨床研究に基づくEBPのイメージ②

平均年齢70歳の中等度運動障害を持つ脳卒中患者に対し、課題指向型訓練を30分、週5回、4週間行ったら4週後に軽度運動障害まで改善した。

担当の脳卒中患者さん(70歳・中等度運動障害)に、課題指向型訓練を30分、週5回、4週間行ったら4週後に運動障害が軽度のレベルになる可能性が高いぞ!
課題指向型訓練の効果を報告したランダム化比較試験を参考にし、自分の担当患者さんへのリハビリプログラムを立案します。
Basic Science Research Evidence (基礎研究)とは?
患者さんだけでなく健常者、動物、細胞標本などを対象とし、健康と病気における原因やメカニズムの特定を行う研究です。
神経科学や運動学、解剖学、生理学などの研究が当てはまります。
基礎研究に基づくEBPのイメージ①

平均年齢60歳、歩行見守りレベルの脳卒中患者の麻痺側下肢推進力低下の原因を調べたところ、足関節底屈力の低下が主要な原因だった。

担当の脳卒中患者さん(60歳・歩行見守りレベル)の麻痺側下肢推進力の低下の原因は足関節底屈の弱さかも!ステップポジションで蹴り出しの練習をしよう!
基礎研究に基づくEBPのイメージ②

平均年齢70歳、中等度運動障害の脳卒中患者においては、半球間抑制の不均衡が麻痺側上肢のピンチ動作能力の低下の一因になっている。

担当の脳卒中患者さん(70歳・中等度運動障害)のピンチ動作がうまくいかないのは半球間抑制のせいかも!非損傷側の脳活動を抑えるために、非麻痺側のリラクゼーションをしよう!
基礎研究からセラピストが考案した臨床アイデアは、太字にしています。
ここが『なぜ臨床研究に基づくべきか』を説明する上で大事なポイントになります。
EBPはどちらのエビデンスに基づくべき?
エビデンスには臨床研究と基礎研究の2種類があるとお伝えしました。
さて、どちらに基づいてEBPを進めるべきでしょうか?
…
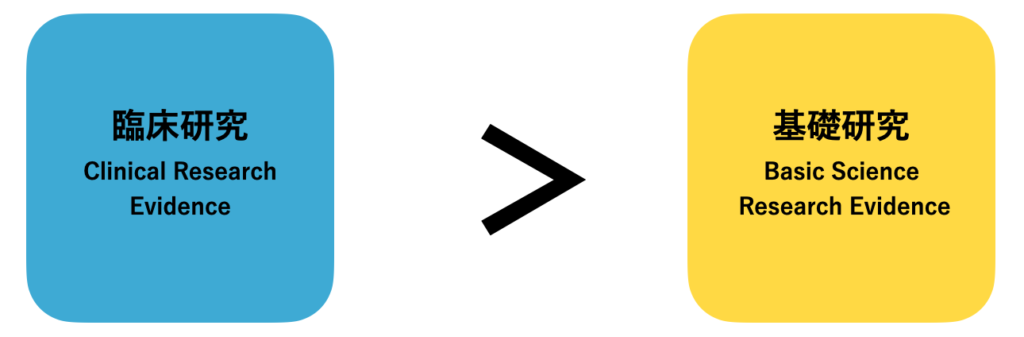
答えは、臨床研究です。
アメリカの書籍『Evidence Based Physical Therapy 2nd Edition』の中で、著者のLinda Fetters先生はこう述べています。
“特定のテーマについて十分な臨床研究が行われていない場合、セラピストは患者の治療・ケアについての洞察を得るために基礎研究に目を向けることができる”
Linda Fetters 2019
これは『Evidence Based Physical Therapy 2nd Edition』に記載されている文章を日本語訳したものですが、海外で出版されている他の文献を読んでも、同じようなことが言われています。
つまり、EBPではまずランダム化比較試験など臨床研究に基づくべきであり、十分な研究が行われていない場合には神経科学や運動学、解剖学などの基礎研究を参考にする、ということです。
では、なぜ臨床研究に基づくべきなのでしょうか?
なぜ臨床研究に基づくべきなのか?
上述の通り、臨床研究は、『トレッドミルトレーニングを行ったら歩行の自立度が向上した』『CI療法を行ったらADLの自立度が向上した』のような、特定の介入方法が何かを改善させたデータです。
リハビリの目的って何だっけ?
私たちがリハビリをする目的は、患者さんに “よくなっていただく” ことですよね。
注意
“よくなる” には広い意味が含まれていて、ADLの自立度向上を指す場合もあれば、歩行の自立度向上を指す場合もあり、運動障害の改善や痙縮の改善、あるいは高次脳機能障害の改善を指す場合もあります。
つまり、私たちのリハビリは患者さんのADLの自立度や歩行の自立度などに繋がらなければ意味がありません。
『腕や脚が軽くなったけど歩行が自立しなかった・ADLが自立しなかった』では患者さんが困ってしまいますよね。
なのでリハビリの目的は患者さんにとって大事な結果、ADLや歩行の自立、運動障害の改善などを指すことが多く、私たちはこの目的を達成するためにリハビリを行っています。
したがって、「どういうリハビリをすればADLや歩行の自立度がよくなるのか?」あるいは「どういうリハビリをすれば運動障害や痙縮がよくなるのか?」という情報が必要になります。
臨床研究に基づいたEBPは “大事な結果” の改善につながる可能性が高い
繰り返しになりますが、臨床研究は『トレッドミルトレーニングを行ったら歩行の自立度が向上した』『CI療法を行ったらADLの自立度が向上した』のような、特定の介入方法が何かを改善させたデータです。

つまり、臨床研究に基づいてリハビリを行うと、ADLや歩行の自立、運動障害や痙縮の改善など、 “患者さんにとって大事な結果” につながる可能性が高いと言えます。
例えば、トレッドミルトレーニングは臨床研究を通して、歩行能力の向上に有効であることが科学的に実証されています。
歩行能力に対し科学的に有効性が実証されたトレッドミルトレーニングを担当患者さんに行えば、担当患者さんの歩行能力も向上する可能性が高いですよね。
基礎研究に基づいたEBPは “大事な結果” の改善につながるかどうかわからない
一方で、基礎研究をもとにセラピストが考案したアイデアは、ADLや歩行の自立、運動障害や痙縮の改善など、”患者さんにとって大事な結果” につながるかどうかわかりません。
それどころか、むしろ患者さんにとって害になる可能性もあります。
例えば、トレッドミルトレーニングは歩く練習なので、転倒する可能性がありますよね。
バランス練習も転倒する可能性があります。
電気刺激は火傷をする可能性があります。
このように、どのリハビリを行う場合でも “介入による効果” と “介入によるリスク” は表裏一体です。
この”介入による効果” と “介入によるリスク” のバランスについても臨床研究や、システマティックレビュー研究を通して検証されます。
例えば、トレッドミルトレーニングや免荷式トレッドミルトレーニングは、確かに転倒するリスクはありますが、他のリハビリと比べて特別にリスクが高いわけではないことが明らかになっています(Mehrholz J, 2017)。
一方、基礎研究をもとにセラピストが考案するアイデアは、”介入による効果” に関するデータも、”介入によるリスク” に関するデータもありません。
ですので、患者さんにとって有益なのか、それとも害になるのかわからないのです。
果たして、効果があるのかないのかわからない、まして害になる可能性すら否定できないオリジナルリハビリを患者さんに適用することが望ましいと言えるでしょうか?
…
…
…
言えないですよね。
だから、EBPは基礎研究ではなく、まずは臨床研究に基づくべきなのです。
CAST STUDYの教訓を想い起こしましょう。
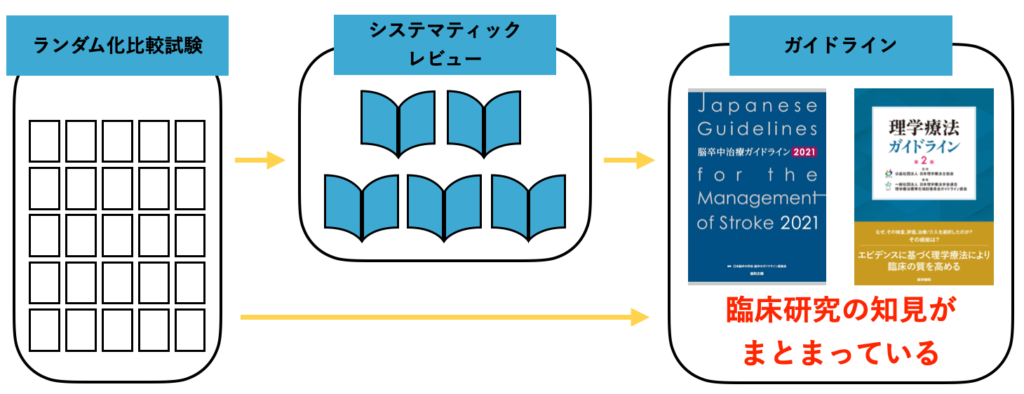
ガイドラインは “臨床研究の集合体”
これらを踏まえて、本題に入っていきます。
最初にお伝えしておきたいのは、『ガイドラインは “臨床研究の集合体” である』ということです。
注意
厳密にはもっと色々な要素を含んでいます。今回はガイドラインを簡単に説明するためにこのような表現をしておりますのでご了承ください。
1つの臨床研究だけを頼りにしてはいけない理由
臨床研究には介入、診断、予防、予後など複数のカテゴリが存在しますが、本記事はガイドラインの話なので、介入に絞って話をします。
上述の通り、介入に関する臨床研究の代表格は、”ランダム化比較試験” です。
ランダム化比較試験に基づいてEBPを進めることで、下記のように患者さんにとって大事な結果につながるリハビリを提供できます。

平均年齢60歳の歩行見守りレベルの脳卒中患者に対し、トレッドミルトレーニングを30分、週5回、4週間行ったら4週後に屋内歩行自立レベルになった。

担当の脳卒中患者さん(60歳・歩行見守りレベル)に、トレッドミルトレーニングを30分、週5回、4週間行ったら4週後に屋内歩行が自立する可能性が高いぞ!
では、1本のランダム化比較試験だけを読んでリハビリを決めてしまって良いのでしょうか?
根拠となるデータが正しくなければ患者さんはよくならない
もし、上述の例で示したエビデンスが、間違った情報だったらどうでしょうか?
本当はトレッドミルトレーニングは効果がないのに、この臨床研究では何らかの偶然、あるいは虚偽の記載で患者さんが良くなったと報告していたとしたら…
自分の担当患者さんにトレッドミルトレーニングをやっても、エビデンス通りによくなるわけはないですよね。
なので、自分が参考にしようとしているデータが正しいかどうかを確認する必要があります。
エビデンスの全体を把握する
参考にしようとしているデータが正しいかどうかを判断する方法のひとつに、『情報の全体を見る』があります。
例えば、『トレッドミルトレーニングによって歩行能力が向上した』という臨床研究を見つけたとします。
EBPは臨床研究に基づくべきですから、この臨床研究に基づいて、患者さんにトレッドミルトレーニングを提案するのは正しいように見えます。
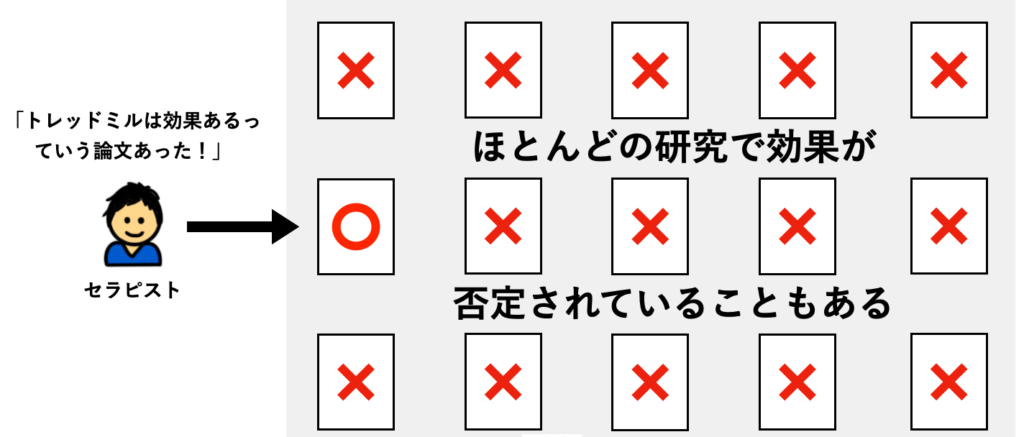
でも、実は『トレッドミルトレーニングによって歩行能力が向上した』と報告している臨床研究はたった1つしかなく、その他の臨床研究の全てで『トレッドミルトレーニングによって歩行能力が向上しない』と報告されているとしたらどうでしょうか?
・
・
・
おそらく、ほとんどの方がトレッドミルトレーニングをやらないのではないかと思います。
このように、1つの臨床研究に『○○療法が有効だった』と報告されていても、多くの臨床研究では『○○療法は有効とは言えない』と報告されているケースはたくさんあります。
“木を見て森を見ず” にならないよう、エビデンスの全体を把握する必要があります。
全体を見るためにシステマティックレビューを読む
ということで、エビデンスの全体を把握しましょう。
トレッドミルトレーニングが有効なのかどうか、PubMedを使って検索します。
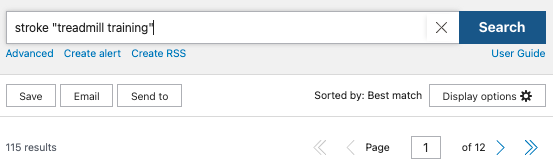
ランダム化比較試験に絞って調べた結果、115件の論文がヒットしました。
注意
今回は簡単なイメージを持っていただきたく、検索式を【stroke “treadmill training”】としましたが、実際はもっと複雑な検索式を作る必要があります。
115件の論文を全て読んで、結果をまとめて、効果を検証するのは大変ですよね。
でも、エビデンスの全体を把握しないと、適切にリハビリを行えないのは上述の通りです。
そこで、システマティックレビュー研究を読みます。
システマティックレビュー
複数の研究を集めて、ひとつの結果・結論を導き出す研究。リハビリの効果を推定する目的の場合、特定のテーマについて世界中のランダム化比較試験が集められることが多い。例えば、運動麻痺に対する課題指向型訓練の効果を調べたランダム化比較試験を100件集めてきて、100件の結果を解析することで課題指向型訓練の有効性を判断する、など。
システマティックレビューを読むことで、情報の全体を把握することができます。
今回はトレッドミルトレーニングトレーニングのシステマティックレビューとして、Mehrholz J (2017) の研究を例に説明します。
この研究では、歩行能力(速度・距離)の向上を目指す場合、歩行が見守りレベル以上の患者さんにはトレッドミルトレーニング(免荷あり・免荷なしどちらも含む)が有効である一方、要介助レベルの患者さんには有効とは言えない、と報告しています。
つまり、(ざっくりな説明ですが)1件のとあるランダム化比較試験に『歩行が自立していない脳卒中患者さんに対してトレッドミルトレーニングを行ったら歩行能力が向上した』と記載されていても、多くの臨床研究では『要介助者には有効とは言えない』と報告されているということです。
なので、自分の担当患者さん(歩行要介助)にトレッドミルトレーニングを行っても、歩行能力の向上に有効でない可能性が高いです。
このように、1つの臨床研究を信じる前に、情報の全体を把握する必要があります。
ガイドラインは “臨床研究の集合体”
さて、冒頭の図をもう一度持ってきます。

ガイドラインは “臨床研究の集合体” です。
ガイドラインではあらゆるシチュエーションや症状に対して『○○を行うことを推奨する』のような推奨が設定されています。
この推奨は、ガイドライン作成メンバーの方々がシステマティックレビューを行い、あらゆる意見を聞き、みんなで話し合った結果、定められます。
したがって、ガイドラインで推奨されているリハビリ方法は、世界中で有効性が報告されており、みんなに認められているリハビリ方法であるということです。
例えば、トレッドミルトレーニングや電気刺激は世界中の臨床研究で有効性が報告されているので、脳卒中治療ガイドライン2021や理学療法ガイドライン第2版でも推奨を受けています。
つまり、ガイドラインに沿ってリハビリを進めるということは、『世界的に有効性が実証されているリハビリを行う』ということになるので、患者さんがよくなる可能性が高いです。
ガイドラインを作成するのにどれくらいのお金と時間がかかるか?
余談になりますが、
理学療法ガイドライン第2版の作成費は、予算ベースでおよそ4,000万円です。
また、システマティックレビュー班1,000人以上で、一人あたり50時間をガイドライン作成のための作業に費やしたとすると、作成に50,000時間要したことになります。
このコストを費やして作成されたのが理学療法ガイドライン第2版です。
もしこの作業を一人でやろうとすると、1日あたり4時間勉強するとしても、50,000時間であれば12,500日、34年はかかる計算です。
また、有料論文の購入費用が1件につき3,000〜5,000円かかりますので、費用も何千万円になると思われます。
これを6,000円で入手できるなら、お得ですよね?
私は医学書院とも日本理学療法士協会とも繋がりがあるわけではないですが、患者さんのためにガイドラインを入手し、読むことを強くお勧めします。
ガイドラインを臨床に活かす4つのステップ
最後に、ガイドラインを臨床に活かすためのステップを紹介します。
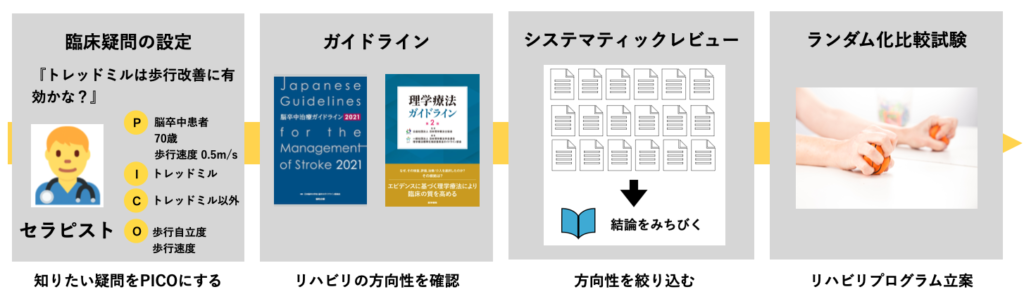
基本的には①臨床疑問を整理する②ガイドラインでリハビリの方向性を確認する③システマティックレビューでリハビリの方向性を確認する④ランダム化比較試験で具体的なリハビリプログラムを作成する、の4ステップです。
ちなみに、EBPの5ステップがありますが、ここで紹介する4ステップは、EBPの5ステップで言うとステップ1〜2で行われるイメージです。
以上、ガイドラインの有効性について解説させていただきました。
11月27日(土)18:30〜21:00で『チャリティーイベント 理学療法ガイドライン第2版を臨床に活かすための勉強会』を開催します。
実際にガイドラインをどのように臨床に活かせばいいのか、もう少し踏み込んだ話をする予定ですので、よかったらご参加ください!
この勉強会は集まった参加費用の全額(配送費用などの手数料を除く)とBRAINの自己資金で理学療法ガイドライン第2版を購入し、ガイドラインが置かれていない施設へ寄付するチャリティーイベントです。
参考文献
Linda Fetters, Evidence Based Physical Therapy Second Edition. 2019. pp3-4
Mehrholz J, Thomas S, Elsner B. Treadmill training and body weight support for walking after stroke. Cochrane Database Syst Rev. 2017 Aug 17;8











