痙縮(けいしゅく)は、脳梗塞や脳出血(以下、脳卒中といいます)の後遺症のひとつです。
本記事では、脳卒中後の痙縮に関する研究論文を25本まとめました。
痙縮を学習したい方にとっては役に立つ情報になると思いますので、よかったらご覧ください。
ホームページやnoteなどのインターネット上の利用であれば、画像、文章の転載OKです!ただし、その場合は必ず転載するnoteやブログ記事に本記事のリンクを貼り付けてください!
情報の信頼性について
・本記事はBRAIN代表/理学療法士の針谷が執筆しています(執筆者情報は記事最下部)。
・本記事の情報は、基本的に信頼性の高い研究から得られたデータを引用しています。

BRAINアカデミー
エビデンスに基づく脳卒中リハビリテーションを体系的・網羅的に学ぶ、6ヶ月間のオンライン学習プログラムです。①動画教材 ②課題 ③フィードバックを通じて、EBMを身に付けましょう!
詳細はこちら
痙縮とは?
痙縮というのは、脳卒中や脊髄損傷など、脳や脊髄にダメージを受けた後に生じる筋緊張の高まりのことです。
意図していないのに肘や指が曲がってしまったり、膝やつま先が伸びてしまう現象として表れます。
本記事の使いかた
・本記事は脳卒中当事者の方やご家族様、経験年数の短いセラピストさんが痙縮の予後、評価、リハビリについて理解いただけるよう、なるべく簡単でわかりやすい表現を用いて執筆しております。経験のあるセラピストさんには物足りない内容になっていると思いますが、情報の根拠になった論文は有益な論文が揃ってますので、ぜひ原著論文へアクセスしてみてください。著者名をクリックすることでPubMedへジャンプします。なお、『英語を読めない!』とお困りの方はこちらの記事をご覧ください。10分で英語論文を日本語で読めるようになる設定をお伝えしてます。
痙縮と運動障害の関係
痙縮は運動障害(手足の動かしづらさ)やリーチ動作と関係していることがわかっています。
以下、運動パフォーマンスと運動機能に分けて解説します。
運動パフォーマンスと運動機能の違い
運動機能は『単関節運動(ひとつの関節だけの運動、例えば手首を動かすなど)や分離運動』を指します。運動パフォーマンスはリーチ動作や歩行動作など、『目的に合わせて複数の関節運動を組み合わせる運動』のことを指します。
リーチ動作と痙縮の関係
何らかの物体に手を伸ばす動作をリーチ動作といいます。
Rech KDら(2020)は、慢性期の脳卒中患者さん34人を対象に、リーチ動作と痙縮との関係を調査しました。
結果として、下記の関係があったことを報告しました(一部抜粋)。
- 痙縮の強さとリーチ動作における肩・肘の関節可動域には負の相関がある(痙縮が強い人は肩の屈曲角度や肘の伸展角度が小さい傾向がある)
- 痙縮の強さとリーチ動作の滑らかさを示すNumber of Movement Unitsには正の相関がある(痙縮が強い人はリーチ動作が滑らかでない傾向がある)
- 痙縮の強さと体幹の前方変位には正の相関がある(痙縮が強い人はリーチ動作時に体幹が大きく前方に動きやすい)
このことから、痙縮が強い人はリーチ動作がうまくいきにくい傾向があることがわかります。
歩行動作と痙縮の関係
Rech KDら(2020)は、歩行動作と痙縮との関係性も報告しています。
しかし、関係性を認めたのは足関節の痙縮の強さとTimd Up and Go Test(TUG)のスコア(秒数)のみでした。
痙縮が強い人はTUGのスコアが良くない傾向があるということです。
歩行速度やステップ長、立ち座りの速さなどとは関係性を認めなかったと報告しています。
つまり、痙縮が強い人でも速く歩ける人もいますし、歩幅が大きい人もいるということです。
Rech KDら(2020)の研究をみる限り、上肢の痙縮はリーチ動作の良し悪しに影響を与えている可能性がありますが、下肢の痙縮は歩行動作の良し悪しとは関係がなさそうです。
運動障害と痙縮の関係
Pundik Sら(2019)は、慢性期の脳卒中患者さん128人を対象に、上下肢の運動障害と痙縮との関係を調査しました。
なお、運動障害はFugl-Meyer Assessment Upper Extremity(以下、FMAUE)と、Fugl-Meyer Assessment Lower Extremity(以下、FMALE)で測定しました。
痙縮はModified Ashworth Scale(MAS)で測定しました。
結果として、運動障害は痙縮の予測因子であることを報告しました。
つまり、運動障害があると痙縮が生じやすいということです。
下肢の筋出力と痙縮の関係
Abdollahi Iら(2015)は慢性期の脳卒中患者さん40人を対象に、下肢の等速性筋出力と痙縮との関係を調査しました。
結果として、筋出力と痙縮との間には弱い相関関係を認めた、と報告されています。
このことから、筋出力が低い脳卒中患者さんほど痙縮が強い傾向にあることがわかります。
これらをまとめると
- 痙縮と上肢の運動パフォーマンス(リーチ動作)は関係性がある
- 痙縮と下肢の運動パフォーマンス(歩行動作)には関係性があると言えない
- 痙縮と上下肢の運動障害には関係性がある
- 痙縮と下肢の筋出力には関係性がある
…ということになります。
痙縮の一般的な経過
痙縮は、一般的に、脳卒中発症から1ヶ月までに出現し、3ヶ月まで悪化し、その後は維持されることが多いです。
発症から1ヶ月までに痙縮が出現
脳卒中患者さん100人以上を対象にした2つの研究で、『痙縮の有病率』が報告されています(Opheim A, 2014; Katoozian L, 2018)。
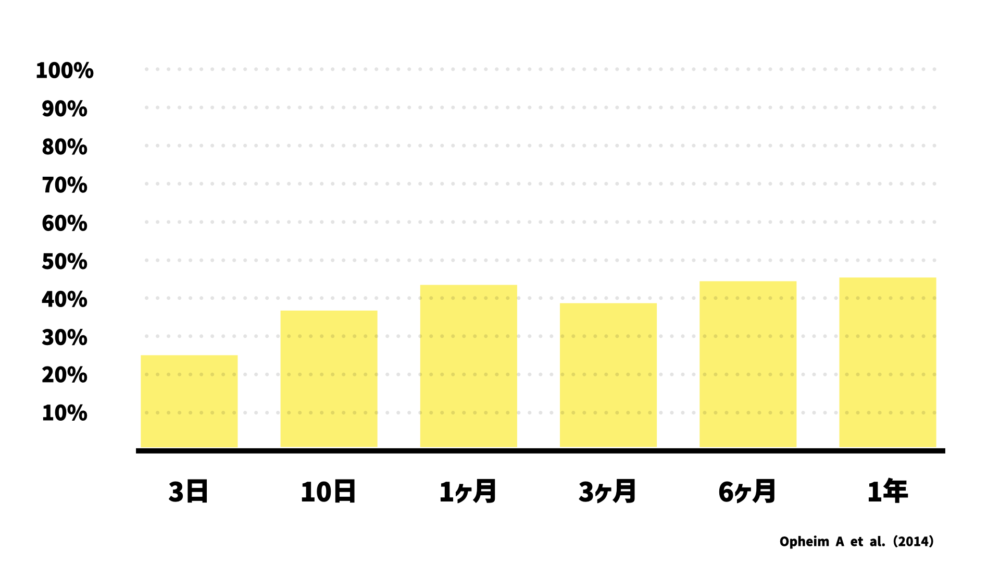
Opheim Aら(2014)は、患者さん117人を対象に、脳卒中発症から3日、10日、1ヶ月、3ヶ月、6ヶ月、12ヶ月の6回にわたって痙縮の有無を調査しました。
結果として、3日で20%強、10日で30%強、1ヶ月で40%強、3ヶ月で40%弱、6ヶ月で40%強、1年で40%強の人たちに痙縮が現れていたことが報告されています。
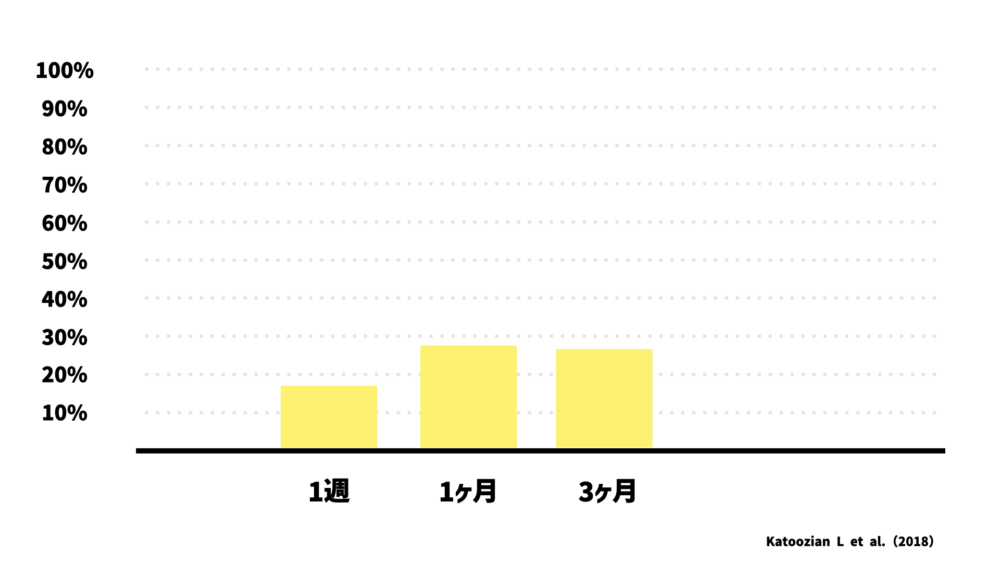
また、Katoozian Lら(2018)は、患者さん149人を対象に、脳卒中発症から1週間、1ヶ月、3ヶ月の3回にわたって痙縮の有無を調査しました。
結果として、発症から1週間時点で痙縮がある人は17.4%、1ヶ月では25.9%、3ヶ月では25%だったことを報告しています。
これらのデータは、『発症直後よりも発症1ヶ月後の方が痙縮を持っている患者さんの人数が多い』ことを示しています。
つまり、発症直後は『痙縮なし』と判定されていたのに、1ヶ月ごろになると『痙縮あり』と判定される患者さんが増えるということです。
このことから、痙縮は『発症直後ではなく、あとになってから出現する』ことがわかります。
発症から3ヶ月までに痙縮が出現しなければその後出現する可能性は低い
発症から1ヶ月までに痙縮が出現する人が多いのは事実ですが、2ヶ月、3ヶ月で出現する人もいます。
Nam KEら(2019)は、痙縮が出現した861人の患者さんを対象に、『いつ痙縮が出現していたか』を調べました。
この研究によると、痙縮をもつ患者さんの50%が発症から1ヶ月以内に、25%が1〜2ヶ月に、12%が2〜3ヶ月に出現していたことが明らかになりました。
痙縮をもつ人のうち87%が発症3ヶ月までに出現しているということです。
言い換えると、発症から3ヶ月以降に痙縮が出現するのは13%ということになり、3ヶ月までに出現しなければその後出現する可能性は低いと言えます。
痙縮は3ヶ月まで悪化する
先に紹介した2つの研究では、痙縮の進行状況も調査されています(Opheim A, 2014; Katoozian L, 2018)。
どちらの研究も、経過とともに『より重度な痙縮を持つ人が増える』ことを報告しています。
つまり、発症から間もないころは『軽度の痙縮』と判定されていたのに、時間が経つにつれ『中・重度の痙縮』と判定される患者さんが増えるということです。
このことから、痙縮は『時間とともに悪化する』ことがわかります。
ただし、経過とともにずっと悪化し続けるわけではありません。
痙縮の重症度の変化を報告したLee KBら(2019)の研究によると、『発症から3ヶ月と6ヶ月の重症度に差はなかった』と報告しています。
つまり、発症3ヶ月までは悪化してしまいますが、3ヶ月以降は悪化するとは言えないということです。
もちろん個人差があり、3ヶ月以降も悪化してしまう人もいますのでご注意ください。
痙縮が出現しやすい人
Wissel Jら(2015)はPubMedを使って、痙縮の予測因子について文献調査を行いました。
取り込まれた7件の研究から、将来の痙縮の予測因子として
- 重度の運動障害(発症2〜10日での)
- 痙縮の存在(発症1〜14日での)
- 低いADL自立度(発症1〜14日での)
などを挙げています。
ざっくりですが、『重度障害がある患者さんは痙縮が発現・持続しやすい』と言えそうです。
原著にはその他の予測因子や予測される時期など詳細に報告されていますので、原著もぜひご確認ください。
痙縮が起こるメカニズム
他の症状と比べ、痙縮の発現が遅れるのには理由があります。

痙縮は上図のように、いくつもの要素が時間とともに複雑に絡み合った結果として生じるものだからです。
以下、ひとつひとつの要素を解説します。
中枢神経系の問題
神経可塑性
脳卒中は脳にダメージを受ける病気です。
これにより “運動麻痺” という手足を動かすことができない症状が表れます。
ヒトの脳は、傷ついた脳を修復し、再び動けるようになるために修復を試みます。
これを神経可塑性と言いますが、よくも悪くも、この神経可塑性によって神経が過活動な状態になり、痙縮の一因になっているとされています。
筋の過活動
筋は脊髄から指令を受けているので、神経の可塑的な変化により神経が過活動な状態になると、筋の過活動が生じます。
これが痙縮につながります。
日常生活の問題
不動
運動麻痺があると、日常生活で手や足を動かすことができなくなってしまいます。
これによって神経の可塑的な変化が引き起こされたり、筋肉の短縮、関節の拘縮が生じたりします。
筋の短縮位での保持
肘関節を屈曲(曲げる)すると、上腕二頭筋が短縮し、上腕三頭筋が伸張されます。
この状態でずっといると、上腕二頭筋は短縮位(短縮した状態)で保持されることになります。
これは関節の拘縮を引き起こすことにつながります。
筋骨格系の問題
“不動” や “筋の短縮位での保持” が続くと、拘縮が生じます。
拘縮は、痙縮を悪化させる要因のひとつであると考えられています。
脳卒中後の神経の可塑的な変化を完全にコントロールすることはできませんが、痙縮の発生や進行を予防するために、『不動にさせない』『筋が短縮位にならないようポジショニングする』などの対応は有効かもしれません。
本当に『不動にさせない』『ポジショニングする』が有効か?
本来であれば、こういった『メカニズムから考えれば○○の方がいいはず』という臨床的なアイデアは、臨床研究を通してその有効性が確認されてから使われるべきです。ただ、現状では私が調べる限り『不動にさせない』『ポジショニングする』ことによって痙縮の進行を予防できたとする臨床研究はありません。ですので、あくまで参考程度に留めていただけますと幸いです。ちなみに、ポジショニングにより “拘縮” を予防できた、という報告はあります(Ada L, 2005)。
痙縮と中枢神経系
痙縮のメカニズムのうち、中枢神経系の問題に焦点を当てていくつかエビデンスを紹介します。
痙縮に関与する脳領域
Lee KB(2019)らは、痙縮がある45人の脳卒中患者を対象に、脳の損傷領域と痙縮との関係を後ろ向き観察研究で調べました。
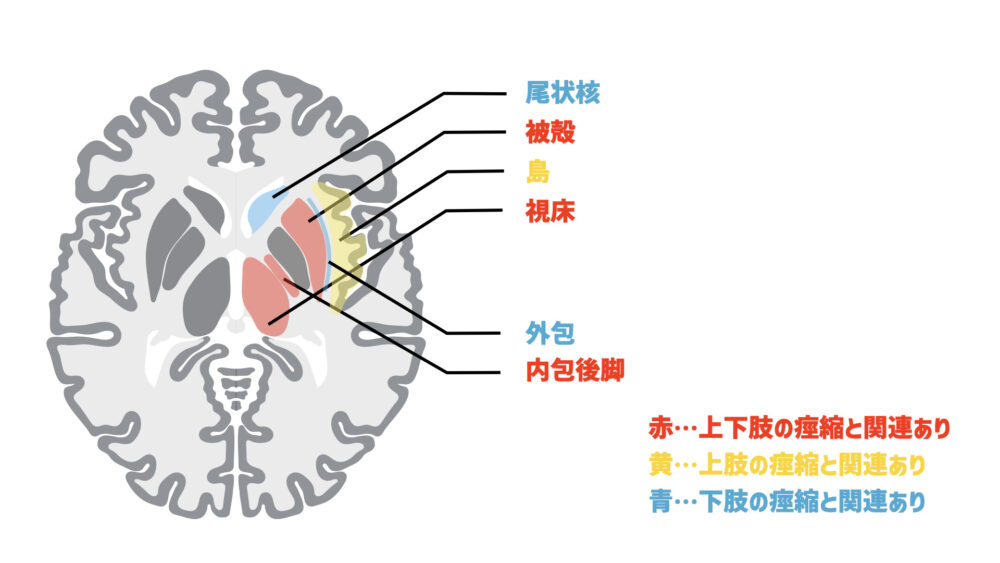
結果として、上肢の痙縮と関係がある脳領域を
- 放線冠
- 内包後脚
- 視床
- 被殻
- 運動前野
- 島
下肢の痙縮と関係がある脳領域を
- 放線冠
- 内包後脚
- 尾状核
- 視床
- 被殻
- 外包
…と報告しています。
ただ、上記の脳領域に損傷があれば必ず痙縮が出現するわけではありませんのでご注意ください。
また、Cheung DKら(2016)は、97人の脳卒中患者を対象に、脳の損傷領域と痙縮との関係を後ろ向き観察研究で調べました。
結果として、上肢の痙縮を持つ人は被殻、内包後脚、外包、視床、島に病変があることが多かったことを報告しています。
この研究では病変の大きさ(体積)とMASスコアの正の相関関係も報告しており、病変が大きい人ほど痙縮も重度である傾向が明らかにされました。
痙縮に関わる脳幹の神経
脳幹には、網様体脊髄路、前庭脊髄路など色々な神経があります。
これらの神経は脊髄に対して促通(筋緊張を上げる)の役割を持つものもあれば、抑制(筋緊張を下げる)の役割を持つものもあります。
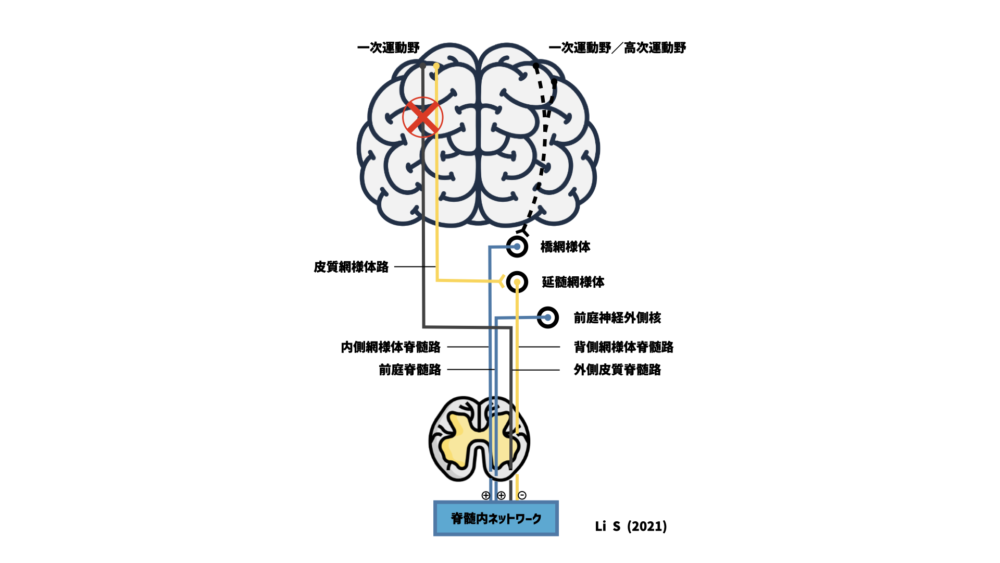
抑制よりも促通が強くなると筋緊張が上がり、痙縮を引き起こす要因になります。
現在では、促通の役割を持つ脳幹の神経のうち、『内側網様体脊髄路』が痙縮に大きな影響を与えることが示唆されています(Li S, 2021)。
本来、内側網様体脊髄路は座位・立位などで姿勢を保つために身体全体の筋緊張を上げる役割を持っている神経です。
背臥位では痙縮が強くなくても、座位や立位では痙縮が強くなるという経験はありませんか?
Qin W(2019)は3つの臨床評価を使って臥位・座位・立位における痙縮の強さを調べました。
痙縮の測定法はModified Ashworth Scale(MAS)、Modified Tardieu Scale(MTS)のほか、Triple Spasticity Scale(TSS)の3つが使われています。
結果として、座位・立位は臥位よりも痙縮が強いと判定されました。
なお、MTSとTSSで測定した場合、座位よりも立位の方がさらに痙縮が強いと判定される結果になりました。
痙縮の影響をよりよく理解するためには、安静時だけでなく、様々な体位(立位、座位、仰臥位)で、そして可能な限り運動時も痙縮を調べる必要がある。
…と提唱しています。
内側網様体脊髄路が座位・立位のときに姿勢を保とうとして活動する結果、筋緊張が上がり、同時に痙縮も強くなるのかも知れません。
痙縮の評価
痙縮の測定法の全体像
Aloraini SMら(2015)は痙縮の測定法をまとめています。
この研究ではさまざまな測定法が報告されました。
- Modified Ashworth Scale (MAS)
- Modified Tardieu Scale (MTS)
- Tone Assessment Scale (TAS)
- Categorization of tone and visual analogue scale (VAS)
- Ankle plantarflexors tone scale (APTS)
- 3-item hypertonus measure
- The tonic stretch reflex threshold (TSRT)
- Pendulum test
…などです。
しかし、『これらの測定法の信頼性や妥当性を裏付けるエビデンスが不足している』と結論づけられています。
つまり、『この方法なら精確に痙縮を測定できます』と言える測定法が存在していないということです。
本記事では海外の痙縮研究でよく使われているModified Ashworth ScaleとModified Tardieu Scaleを紹介します。
ちなみに、Aloraini SMら(2015)の研究でも、取り込まれた研究数がもっとも多かったのがMAS(18件)、次いでMTS(5件)でした。
MASは世界的によく研究されていることがわかります。
Modified Ashworth Scale
対象者の四肢をセラピストが他動的に動かし、その抵抗の程度から点数をつける測定法です。
ポイントは
- 背臥位で測定する
- 対象の関節を完全屈曲位から1秒かけて完全伸展位まで動かす
- (対象の関節によっては完全伸展位から完全屈曲位へ)
- 以下の分類に基づいてスコアをつける

詳しくはこちらをご覧ください。
https://www.sralab.org/rehabilitation-measures/ashworth-scale-modified-ashworth-scale
Modified Tardieu Scale
こちらもMASと同様、対象者の四肢をセラピストが他動的に動かす検査です。
MASとの違いをざっくり紹介すると
- 上肢の測定は座位、下肢の測定は背臥位で行う
- 関節を動かす速度がV1〜V3の3段階ある
- 引っかかりが生じた角度を記録する
があります。
詳しくはこちらをご覧ください。
https://www.jstage.jst.go.jp/article/rigaku/33/2/33_KJ00004317390/_article/-char/ja/
https://www.sralab.org/rehabilitation-measures/tardieu-scalemodified-tardieu-scale
MASは簡便である上に、Meseguer-Henarejos ABら(2018)によると信頼性もある程度確認されていますので、ひとまずはMASを使えるようになっていただければOKです。
痙縮に対するリハビリ
日本脳卒中学会が出版している『脳卒中治療ガイドライン2021』では、下記の治療法が推奨されています。
- ボツリヌス毒素療法
- フェノールによる運動点ブロック
- 髄腔内バクロフェンポンプ療法
- 経口筋弛緩薬
- 装具療法(手関節・手指を持続的に伸展させる装具、つまりストレッチ)
- 経皮的電気刺激
上から4つまでは医師が行う治療法です。
本記事ではセラピストが扱うことができるストレッチ、電気刺激に加え、近年有効性が報告されている振動刺激について紹介します。
ストレッチ

Salazar APら(2019)は、痙縮に対する上肢のストレッチの効果を調べるため、文献調査を行いました。
結果として、静的ストレッチは何もしない・通常ケア・従来の理学療法をする場合と比べると、手関節屈曲の痙縮に対し有効だということを報告しました。
また、Bani-Ahmed A(2019)は、痙縮に対する下肢のストレッチの効果を調べるため、文献調査を行いました。
結果として、下肢への静的ストレッチの痙縮への効果を報告した研究は4件あり、うち3件で痙縮を低下させるという報告をしていたことがわかりました。
ただし、上肢も下肢も徒手的なストレッチではなく、強制的に関節を伸ばす道具や機械を使って20分以上行われた結果です。
つまり、セラピストがよく臨床で行う徒手的なストレッチが有効というわけではありませんのでご注意ください。
電気刺激
世界中で、脳卒中後の痙縮に対して電気刺激が有効なのかどうか調査されており、その有効性が文献調査でも報告されています(Mahmood A, 2019; Stein C, 2015)。
Stein Cら(2015)の研究では、電気刺激が痙縮の改善に有効であることを報告しました。
ただし、この研究では下肢の痙縮に対しては有効性を認めたものの、上肢の痙縮に対しては有効性を認めなかったことを報告しています。
ガイドラインでは痙縮に対し電気刺激が推奨されているものの、上肢にも下肢にも有効というわけではないので注意が必要です。
電気刺激にはいくつかのタイプがありますが、脳卒中リハビリテーションで使用される電気刺激は主に以下の3つです。
- 神経筋電気刺激(Neuromuscular Electrical Stimulation: NMES)
- 経皮的電気刺激(Transcutaneous Electrical Nerve Stimulation; TENS)
- 筋電トリガー式電気刺激
脳卒中を発症してからの経過時間や刺激のしかたによって期待できる効果が異なりますので、パラメータ・条件設定が重要になります。
振動刺激

電気刺激と比べると研究数は少ないですが、局所的振動刺激も痙縮に対する有効性が報告されています(Avvantaggiato C, 2021)。
電気刺激は上肢の痙縮に対しては否定的な報告がなされています(Stein C, 2015)が、振動刺激は有効なのが特徴的です。
なお、振動刺激も周波数や適用部位によって期待できる効果が異なりますので、パラメータ・条件設定が重要です。
例えば、Avvantaggiato Cら(2021)の研究では、肘関節屈曲の痙縮に対しては上腕二頭筋ではなく上腕三頭筋に当てないと有効とは言えないと報告しています。
有効なパラメータ・条件設定について把握するためには、システマティックレビューやランダム化比較試験などの研究論文をしっかり読む必要があります。
『筋力トレーニングで痙縮が悪化する』は本当?
Ada Lら(2006)とVeldema Jら(2020)は、筋力トレーニングによって痙縮が悪化するのか調べるために、文献調査を行いました。結果として、両者とも『筋力トレーニングが痙縮を悪化させるとは言えない』と結論づけています。したがって、現時点でのエビデンスをもとに考えると『痙縮の悪化を理由に筋力トレーニングを行わないことは適切ではない』と言えます。
脳卒中後の痙縮に関するエビデンスをまとめました。
本記事の内容が少しでもお役に立てば幸いです。

文献検索CAMP
PubMedを使った文献検索を2日でマスターしていただく集中オンライン学習プログラムです。AIを活用し、経験1年目の方でも文献検索を行えるレベルまでスキルアップできます。
詳細はこちら
参考文献
Rech KD, Salazar AP, Marchese RR, Schifino G, Cimolin V, Pagnussat AS. Fugl-Meyer Assessment Scores Are Related With Kinematic Measures in People with Chronic Hemiparesis after Stroke. J Stroke Cerebrovasc Dis. 2020 Jan;29(1):104463.
Pundik S, McCabe J, Skelly M, Tatsuoka C, Daly JJ. Association of spasticity and motor dysfunction in chronic stroke. Ann Phys Rehabil Med. 2019 Nov;62(6):397-402.
Abdollahi I, Taghizadeh A, Shakeri H, Eivazi M, Jaberzadeh S. The relationship between isokinetic muscle strength and spasticity in the lower limbs of stroke patients. J Bodyw Mov Ther. 2015 Apr;19(2):284-90.
Opheim A, Danielsson A, Alt Murphy M, Persson HC, Sunnerhagen KS. Upper-limb spasticity during the first year after stroke: stroke arm longitudinal study at the University of Gothenburg. Am J Phys Med Rehabil. 2014 Oct;93(10):884-96.
Katoozian L, Tahan N, Zoghi M, Bakhshayesh B. The Onset and Frequency of Spasticity After First Ever Stroke. J Natl Med Assoc. 2018 Dec;110(6):547-552.
Nam KE, Lim SH, Kim JS, Hong BY, Jung HY, Lee JK, Yoo SD, Pyun SB, Lee KM, Lee KJ, Kim H, Han EY, Lee KW. When does spasticity in the upper limb develop after a first stroke? A nationwide observational study on 861 stroke patients. J Clin Neurosci. 2019 Aug;66:144-148.
Wissel J, Verrier M, Simpson DM, Charles D, Guinto P, Papapetropoulos S, Sunnerhagen KS. Post-stroke spasticity: predictors of early development and considerations for therapeutic intervention. PM R. 2015 Jan;7(1):60-7.
Ada L, Goddard E, McCully J, Stavrinos T, Bampton J. Thirty minutes of positioning reduces the development of shoulder external rotation contracture after stroke: a randomized controlled trial. Arch Phys Med Rehabil. 2005 Feb;86(2):230-4.
Lee KB, Hong BY, Kim JS, Sul B, Yoon SC, Ji EK, Son DB, Hwang BY, Lim SH. Which brain lesions produce spasticity? An observational study on 45 stroke patients. PLoS One. 2019 Jan 24;14(1):e0210038.
Cheung DK, Climans SA, Black SE, Gao F, Szilagyi GM, Mochizuki G. Lesion Characteristics of Individuals With Upper Limb Spasticity After Stroke. Neurorehabil Neural Repair. 2016 Jan;30(1):63-70.
Li S, Francisco GE. New insights into the pathophysiology of post-stroke spasticity. Front Hum Neurosci. 2015 Apr 10;9:192.
Li S, Francisco GE, Rymer WZ. A New Definition of Poststroke Spasticity and the Interference of Spasticity With Motor Recovery From Acute to Chronic Stages. Neurorehabil Neural Repair. 2021 Jul;35(7):601-610.
Qin W, Yang M, Li F, Chen C, Zhen L, Tian S. Influence of positional changes on spasticity of the upper extremity in poststroke hemiplegic patients. Neurosci Lett. 2019 Nov 1;712:134479.
Bethoux F. Spasticity Management After Stroke. Phys Med Rehabil Clin N Am. 2015 Nov;26(4):625-39.
Ward AB. A literature review of the pathophysiology and onset of post-stroke spasticity. Eur J Neurol. 2012 Jan;19(1):21-7.
Sunnerhagen KS. Predictors of Spasticity After Stroke. Curr Phys Med Rehabil Rep. 2016;4:182-185.
Aloraini SM, Gäverth J, Yeung E, MacKay-Lyons M. Assessment of spasticity after stroke using clinical measures: a systematic review. Disabil Rehabil. 2015;37(25):2313-23.
Meseguer-Henarejos AB, Sánchez-Meca J, López-Pina JA, Carles-Hernández R. Inter- and intra-rater reliability of the Modified Ashworth Scale: a systematic review and meta-analysis. Eur J Phys Rehabil Med. 2018 Aug;54(4):576-590.
Salazar AP, Pinto C, Ruschel Mossi JV, Figueiro B, Lukrafka JL, Pagnussat AS. Effectiveness of static stretching positioning on post-stroke upper-limb spasticity and mobility: Systematic review with meta-analysis. Ann Phys Rehabil Med. 2019 Jul;62(4):274-282.
Bani-Ahmed A. The evidence for prolonged muscle stretching in ankle joint management in upper motor neuron lesions: considerations for rehabilitation – a systematic review. Top Stroke Rehabil. 2019 Mar;26(2):153-161.
Mahmood A, Veluswamy SK, Hombali A, Mullick A, N M, Solomon JM. Effect of Transcutaneous Electrical Nerve Stimulation on Spasticity in Adults With Stroke: A Systematic Review and Meta-analysis. Arch Phys Med Rehabil. 2019 Apr;100(4):751-768.
Stein C, Fritsch CG, Robinson C, Sbruzzi G, Plentz RD. Effects of Electrical Stimulation in Spastic Muscles After Stroke: Systematic Review and Meta-Analysis of Randomized Controlled Trials. Stroke. 2015 Aug;46(8):2197-205.
Avvantaggiato C, Casale R, Cinone N, Facciorusso S, Turitto A, Stuppiello L, Picelli A, Ranieri M, Intiso D, Fiore P, Ciritella C, Santamato A. Localized muscle vibration in the treatment of motor impairment and spasticity in post- stroke patients: a systematic review. Eur J Phys Rehabil Med. 2021 Feb;57(1):44-60.
Ada L, Dorsch S, Canning CG. Strengthening interventions increase strength and improve activity after stroke: a systematic review. Aust J Physiother. 2006;52(4):241-8.
Veldema J, Jansen P. Resistance training in stroke rehabilitation: systematic review and meta-analysis. Clin Rehabil. 2020 Sep;34(9):1173-1197.











